-
首頁>>
新聞動態>>
必威体育世界杯官网下载
必威体育世界杯官网下载
廣州健康院在非典病毒與新冠病毒刺突蛋白的結構研究中取得進展
近日,betway体育下载 熊曉犁、何俊和陳淩課題組在Life Science Alliance期刊上發表題為“Disulfide stabilization reveals conserved dynamic features between SARS-CoV-1 and SARS-CoV-2 spikes”的研究論文。這項研究利用蛋白重組表達技術,引入設計的二硫鍵對非典型性呼吸道綜合症病毒 (非典病毒,SARS-CoV-1)的刺突蛋白進行工程化改造,穩定了該蛋白以前未觀察到的一些稀有構象,這與新型冠狀病毒 (SARS-CoV-2)和其它沙貝病毒 (Sarbecovirus)的刺突蛋白的某些特殊構象共享一些平行的特征,文章討論這些保守特征可能的生物學功能。
刺突蛋白在冠狀病毒的受體結合與介導入侵的病毒-細胞膜融合過程中有重要功能,冠狀病毒的疫苗研發主要針對刺突蛋白為靶點,新冠病毒的爆發使得其刺突蛋白的結構與功能成為近年來的研究焦點之一。近年來的研究發現,新冠病毒的刺突蛋白在結構上有著很強的構象動態,存在鎖定型、關閉型和打開型三種不同的融合前構象。其中,鎖定構象的S蛋白具有非常緊致的結構,與能結合ACE2受體的“受體結構域(RBD)打開構象”不兼容。對於新冠病毒的S蛋白,研究表明其鎖定構象在中性pH條件下僅能短暫存在,在酸性環境中更為穩定。可能由於在中性環境下鎖定構象的不穩定性,之前未在非典病毒S蛋白的結構研究中觀察到鎖定構象。研究團隊前期針對新冠病毒的S蛋白開發了可以穩定其RBD“down”構象,包括稀有鎖定構象的x1,x2,x3三對二硫鍵1,2,在該研究中研究人員將這三對二硫鍵分別引入非典病毒S蛋白,發現經過改造的非典病毒S-x1,S-x2,S-x3蛋白均能得到表達和提純,負染電鏡下提純的工程刺突蛋白形成了形態完整的顆粒,研究人員測試了S-x3蛋白的免疫效果,與未經改造的刺突蛋白相比,發現S-x3蛋白可以誘導出滴度相當的強中和小鼠血清。
研究人員利用冷凍電鏡技術對改造後的非典病毒S蛋白進行了成像,發現非典病毒的S蛋白存在與新冠病毒S蛋白類似的兩種不同的鎖定型構象 locked-1(3個S蛋白亞基均為鎖定-1構象)和 locked-2(3個S蛋白亞基均為鎖定-2構象),以及不對稱的混合型鎖定構象 locked-112(3個S蛋白亞基兩個為鎖定-1構象,一個為鎖定-2構象)和 locked-122(3個S蛋白亞基兩個為鎖定-2構象,一個為鎖定-1構象)。除此之外,在非典病毒S-x1蛋白的關閉構象中,觀察到其融合肽近端區(FusionPeptideProximalRegion,FPPR)存在特殊的擠出型結構,顯示出該區域特殊的結構動態,這種構象在新冠病毒的x1改造的S蛋白上沒有被觀察到。與新冠病毒S蛋白不同,低pH不能促使非典病毒S蛋白形成鎖定構象。 這些結果揭示了新冠病毒和非典病毒S蛋白之間構象上的相似性和結構動態上的差異性。
本研究發現了非典病毒刺突蛋白存在locked-1和locked-2兩種不同的鎖定構象,這與新冠病毒的刺突蛋白相似。與本研究中觀測到的非典病毒S蛋白的其他構象一起,說明SARS-CoV-1和SARS-CoV-2刺突蛋白存在複雜的結構動態。迄今為止,非典病毒和新冠病毒外的其它沙貝病毒的刺突蛋白主要觀測到locked-2構象,結構分析表明,盡管locked-1和locked-2構象之間的細節不同,但通過結構域D和結構域C-D鉸鏈區之間的相互作用使得刺突蛋白的結構剛性化,維持了鎖定構象的穩定,並抑製RBD運動是沙貝病毒刺突蛋白鎖定構象共有的特征。沙貝病毒刺突蛋白鎖定構象中抑製RBD打開機製的保守性表明,鎖定構象的S蛋白三聚體可能在沙貝病毒生命周期中發揮保守功能,研究組提出鎖定構象可能在病毒的組裝過程中發揮功能,但是該提議還有待後續研究的證實。
該研究由中國科學院提供經費支持,廣州醫科大學,廣州實驗室趙金存研究組、南方科技大學王培毅研究組和廣州生物島實驗室金亮研究組對該研究提供了鼎力協助。
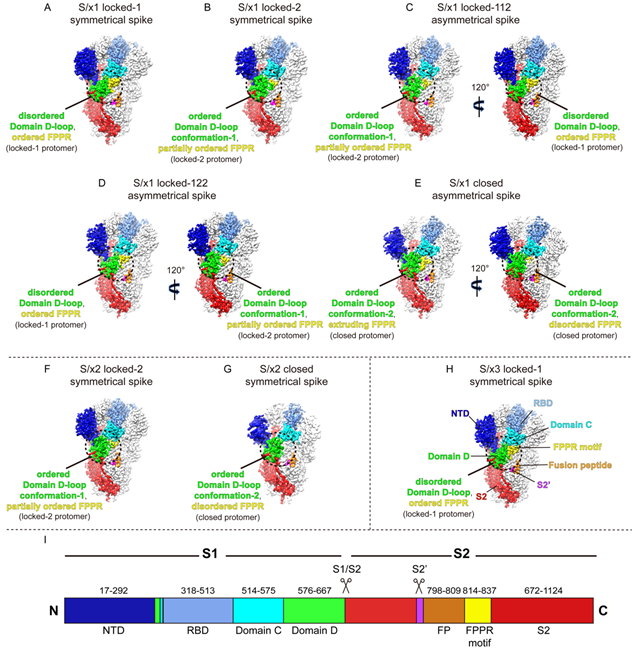
圖1.該研究解析的不同構象的非典病毒刺突蛋白的冷凍電鏡結構
